GUÍA DE APRENDIZAJE 2
QUÍMICA - CIENCIAS NATURALES
INSTITUCIÓN EDUCATIVA BARTOLOME LOBO GUERRERO

=
TUTOR:
SERGIO ARMANDO CÓRDOBA MOSQUERA – LICENCIADO EN CIENCIAS NATURALES Y EDUCACIÓN AMBIENTAL
Correo: sergioacordoba23@gmail.com Teléfono: 3136888463
INFORMACION PARA EL ESTUDIANTE - Lenar la informacion del estudiante que falta en el cuadro.
Asignatura
|
CIENCIAS NATURALES - QUÍMICA
|
Carácter
|
Básico
|
Periodo
|
I
|
Ciclo
|
5-2
|
Tema
|
Quimica
|
Nombre del estudiante
|
Jamer Arlex
|
Apellidos del estudiante
|
Suaza acevedo
|
Correo electrónico del estudiante
|
Jamerss@hotmail.com
|
Duración
|
Una semana
|
Fecha de entrega
|
25 de Mayo
|
Forma de envío
|
Virtual
|
Forma de entrega
|
Virtual
|
Para la entrega del trabajo, se debe tener en cuenta ciertas consideraciones respecto al formato, como las siguientes:
TIPO DE PAPEL - Tamaño: Carta (Letter) MÁRGENES: Hoja: 2.54 cm en cada borde de la hoja (Superior, inferior, izquierda, derecha). FUENTE O TIPO DE LETRA: Fuente: Times New Roman, Tamaño : 12 pts, Alineamiento: Izquierda.

Método Científico:
Es un proceso destinado a explicar fenómenos, establecer relaciones entre los hechos y enunciar leyes que expliquen los fenómenos físicos del mundo y permitan obtener, con estos conocimientos, aplicaciones útiles al hombre.
Paso del método científico

Responda la siguiente pregunta marcando con una X, en la respuesta correcta.
Que es el método científico
El método científico es un proceso de investigación que se puede dividir en las siguientes etapas:
A. Planteamiento del problema
B. Formulación de hipótesis, biología y predicciones x
C. Experimentación y recopilación de datos
D. Interpretación de datos, bibliográfica y conclusiones
 Clasificación de la Materia
Clasificación de la Materia
Clasificación de la materia
La materia la podemos encontrar en la naturaleza en forma de sustancias puras y de mezclas.
Las sustancias puras : Es un material homogéneo constituido por una sola sustancia.
Se dividen en dos grandes grupos: Elementos y Compuestos.
Elementos: Son sustancias puras que no pueden descomponerse en otras sustancias puras más sencillas por ningún procedimiento. Ejemplo: Todos los elementos de la tabla periódica: Oxígeno, hierro, carbono, sodio, cloro, cobre, etc. Se representan en la tabla periódica mediante su símbolo químico (O, Fe, C, Na, Cl, Cu, etc.) y se conocen 115 en la actualidad.
Compuestos: Son sustancias puras que están constituidas por 2 ó más elementos combinados en proporciones fijas. Los compuestos se pueden descomponer mediante procedimientos químicos en los elementos que los constituyen. Ejemplo: Agua, de fórmula H2O, está constituida por los elementos hidrógeno (H) y oxígeno (O) y se puede descomponer en ellos mediante la acción de una corriente eléctrica (electrólisis). Los compuestos se representan mediante fórmulas químicas en las que se especifican los elementos que forman el compuesto y el número de átomos de cada uno de ellos que compone la molécula. Ejemplo: En el agua hay 2 átomos del elemento hidrógeno y 1 átomo del elemento oxígeno formando la molécula H2O.
Las mezclas se encuentran formadas por 2 ó más sustancias puras. Su composición es variable. Se distinguen dos grandes grupos:Mezclas homogéneas y Mezclas heterogéneas.
Mezclas homogéneas: También llamadas Disoluciones. Son mezclas en las que no se pueden distinguir sus componentes a simple vista. Ejemplo: Disolución de sal en agua, el aire, una aleación de oro y cobre, etc.
Mezclas heterogéneas: Son mezclas en las que se pueden distinguir a los componentes a simple vista. Ejemplo: Agua con aceite, granito, arena en agua, etc.
Desarrollar la siguiente pregunta:
Mencione dos ejemplos que encuentres en tu hogar sobre la clasificación de la materia, es decir, mencionar Un ejemplo de sustancia homogénea y heterogénea que puedas identificar en tu hogar; Un ejemplo de sustancias pura, elementos y compuesto y Un ejemplo de disoluciones).
1. Rmezclas homogéneas: Agua con azúcar. Agua con sal.
2 . mezclas heterogéneas: El Agua y aceite. Tierra y aserrín. Agua y diesel. Agua y gasolina. Vinagre y aceite.
3. Sustancia pura
R// agua, sal
Compuesto del agua :Agua. El agua es un compuesto que se forma a partir de la unión, mediante enlaces covalentes, de dos átomos de hidrógeno y uno de oxígeno; su fórmula molecular es H2O y se trata de una molécula muy estable.
Compuesto dede la sal : El cloruro de sodio, sal común o sal de mesa, denominada en su forma mineral como halita, es un compuesto químico con la fórmula NaCl. El cloruro de sodio es una de las sales responsable de la salinidad del océano y del fluido extracelular de muchos organismos.
4 ejemplo de disoluciones
R//:
Agua y azúcar. - En este caso se trata de la mezcla de agua que es un disolvente universal y de azúcar que es una sustancia soluble en agua.
 Propiedades de la materia
Propiedades de la materia
Existen propiedades que permiten conocer y diferenciar una sustancia de otra, las cuales se pueden clasificar en propiedades químicas y propiedades físicas.
Las propiedades químicas de las sustancias son aquellas que ponen de manifiesto cuando se transforma en otras, Por ejemplo la capacidad de combustión es una de ellas.
Las propiedades físicas pueden ser específicas o extensivas:
Propiedades específicas
1. Las propiedades organolépticas , donde se identifican las sustancias utilizando los sentidos , tal como el color, olor, sabor, solubilidad , brillo, transparencia , dureza.
2. Las propiedades intensivas que no depende de la cantidad de sustancias analizada, por ejemplo, densidad, punto de fusión, punto de ebullición, conductividad eléctrica y conductibilidad del calor.
Propiedades extensivas
Estas dependen de la cantidad de sustancia analizada por ejemplo, volumen, peso, masa, tamaño.
Para medir estas propiedades se emplean magnitudes como: longitud, volumen, masa, tiempo, temperatura, cantidad de sustancia (n) y otros.
Unidades básicas en el sistema internacional, SI
Responder la siguiente pregunta.
Menciona un ejemplo de instrumentos o equipos que midan la longitud, la masa. el tiempo, intensidad de la corriente, temperatura e intensidad de la corriente.
R:/ Para medir masa:
Para medir propiedades eléctricas:
Para medir otras magnitudes:
Molécula
La molécula es la unidad más pequeña de sustancia pura capaz de existir independientemente y en forma estable, la molécula es el límite de la subdivisión física.
Una gota de agua está constituida por millones de unidades o moléculas.
Átomo
Los átomos son las unidades a partir de las cuales se forman las moléculas.
Una molécula está compuesta por dos o más átomos. Los átomos constituyen una molécula se pueden separar por métodos químicos.
La molécula de agua está constituida por tres átomos: un átomo de oxigeno y dos de hidrógeno.
La división química de una molécula en moléculas más pequeñas o en átomos, produce cambios en la composición y por lo tanto, cambios en las propiedades. Así una molécula de azúcar común o sacarosa, puede romperse químicamente en dos moléculas: una de glucosa y una de fructuosa. La glucosa y la fructuosa también son azucares pero con propiedades diferentes a las de las sacarosa.
 Relación entre átomo - mólecula-elemento -compuesto
Relación entre átomo - mólecula-elemento -compuesto
Las sustancias puras se clasifican en elementos o compuestos, según la clase de átomos que formen la molécula.
Elemento
Un elemento es una sustancia pura cuyas moléculas están formadas por una sola clase de átomos.
Compuesto
Un compuesto es una sustancia pura cuya molécula está formada por dos o más clases de átomos. Por métodos químicos un compuesto se descompone en compuestos más simples o en elementos, son compuestos el agua, la sacarosa, la isulina, entre otros.
Molécula
La molécula es la unidad más pequeña de sustancia pura capaz de existir independientemente y en forma estable, la molécula es el límite de la subdivisión física.
Una gota de agua está constituida por millones de unidades o moléculas.
Átomo
Los átomos son las unidades a partir de las cuales se forman las moléculas.
Una molécula está compuesta por dos o más átomos. Los átomos constituyen una molécula se pueden separar por métodos químicos.
La molécula de agua está constituida por tres átomos: un átomo de oxigeno y dos de hidrógeno.
La división química de una molécula en moléculas más pequeñas o en átomos, produce cambios en la composición y por lo tanto, cambios en las propiedades. Así una molécula de azúcar común o sacarosa, puede romperse químicamente en dos moléculas: una de glucosa y una de fructuosa. La glucosa y la fructuosa también son azucares pero con propiedades diferentes a las de las sacarosa.
Las sustancias puras se clasifican en elementos o compuestos, según la clase de átomos que formen la molécula.
Elemento
Un elemento es una sustancia pura cuyas moléculas están formadas por una sola clase de átomos.
Compuesto
Un compuesto es una sustancia pura cuya molécula está formada por dos o más clases de átomos. Por métodos químicos un compuesto se descompone en compuestos más simples o en elementos, son compuestos el agua, la sacarosa, la isulina, entre otros.
Desarrollar la siguiente pregunta
Mencionar dos ejemplo de átomos, elementos (Monoatomicos y Diatomicos), compuestos, mezclas.
1 2 ejemplos de átomos
H (hidrogeno), Li (litio), He (helio), S (azufre) y C (carbono).
2elementos ( monográficos y diagnósticos)
R:/Un gas monoatómico' es aquel cuyos átomos no están unidos entre sí. Bajo condiciones normales de presión y temperatura (CNPT), todos los gases nobles son monoatómicos, además de los vapores metálicos.
...
gases monoatómicos y diatomicos.
| Cl2 |
|---|
| Gases diatómicos | Cloro |
|---|
| Cl |
|---|
| Cloro ató |
|---|
4.
Elementos, compuestos y mezclas
Las sustancias son los materiales con los que trabaja el químico y éstas pueden ser puras o no. Las sustancias puras se clasifican en elementos y compuestos.
Los elementos son sustancias simples que no pueden descomponerse por métodos químicos ordinarios.
La mínima unidad material que representa las características de un elemento es el átomo. Un elemento posee átomos iguales entre sí y diferentes a los de otro elemento.
Desde la antigüedad se conocen varios elementos, algunos son muy abundantes, otros son muy raros, algunos son radiactivos y otros se han sintetizado en el laboratorio y tienen una vida muy corta.
Los elementos se representan por medio de un símbolo y se encuentran ordenados en la tabla periódica.
Por ejemplo:














 Propiedades de la materia
Propiedades de la materia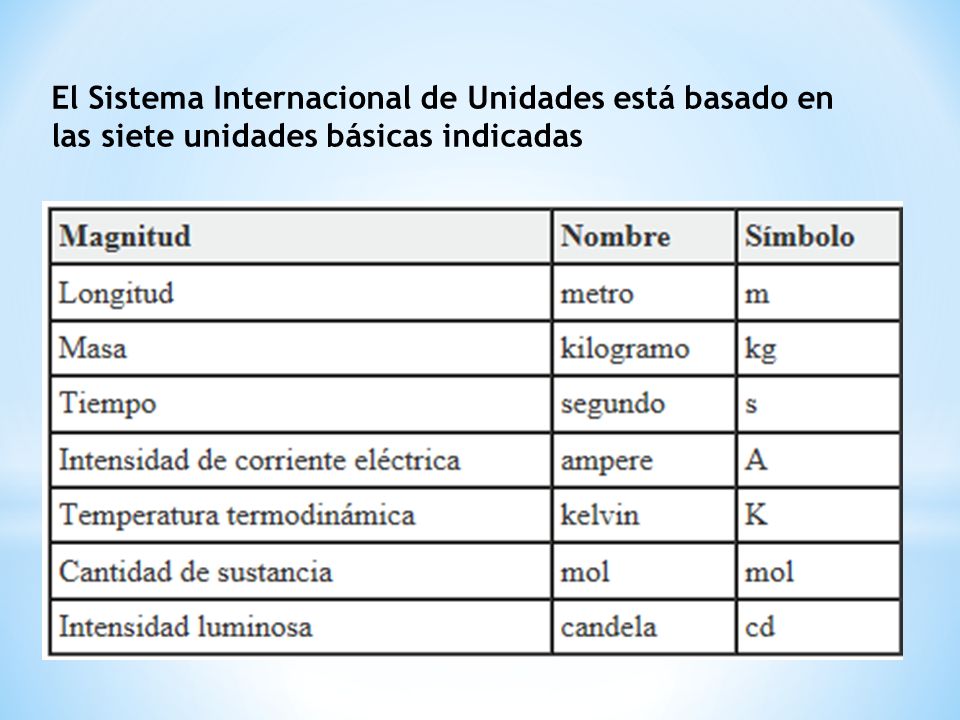



No hay comentarios.:
Publicar un comentario